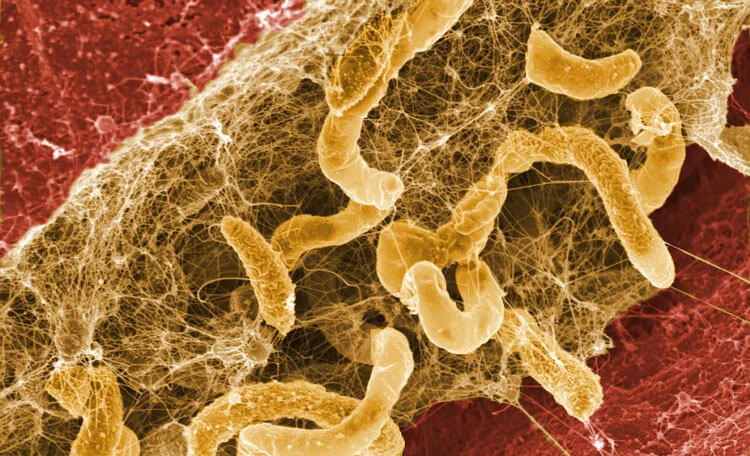
تشکیل بیوفیلم در مراقبت های بهداشتی بسیار قابل توجه است ، زیرا منجر به افزایش مرگ و میر و تحمیل بار مالی قابل توجهی بر سیستم مراقبت های بهداشتی می شود.
بیوفیلم ها در برابر درمان های معمول ضد میکروبی بسیار مقاوم هستند و منجر به عفونت های مداوم می شوند. از این رو ، تقاضای زیادی برای استراتژی های جدید غیر از روش های درمانی آنتی بیوتیکی معمول برای کنترل عفونت های مبتنی بر بیوفیلم وجود دارد.
دو روش وجود دارد که تاکنون برای کنترل تشکیل بیوفیلم در محیط های بهداشتی استفاده شده است
- یکی توسعه مهار کننده های بیوفیلم بر اساس درک مکانیسم مولکولی تشکیل بیوفیلم
- و دیگری اصلاح مواد زیستی که در پزشکی استفاده می شود دستگاه هایی برای جلوگیری از تشکیل بیوفیلم.
بیوفیلم ها کلونی های متصل به هم و نیز سطوح از سلول های میکروبی هستند که در یک ماتریس خارج سلولی ک توسط خودشان تولید شده است قرار دارند و در برابر عوامل ضد میکروبی بسیار مقاوم هستند.
بیوفیلم ها می توانند به انواع سطوح از جمله فلزات ، پلاستیک ها ، بافت های گیاهی و بدن ، دستگاه های پزشکی و مواد کاشتنی متصل شوند.
تشکیل بیوفیلم در دستگاه های پزشکی و ایمپلنت های دایمی مانند
- دریچه های قلب
- ضربان سازهای قلب
- گرافت های عروقی
- سوندها
- مفاصل مصنوعی
- دستگاه های داخل رحمی
- بخیه ها
- لنزهای تماسی
علت اصلی اتواع عفونت است.
استفاده از کاتترهای داخل عروقی برای مراقبت از بیمار می تواند منجر به عفونت جریان خون مرتبط با خط مرکزی (CLABSI) شود و تقریباً 250،000 مورد عفونت اولیه جریان خون هر ساله در ایالات متحده گزارش می شود . بنابراین ، نتایج CLABSI منجر به مرگ و میر و افزایش چشمگیر هزینه های مراقبت های بهداشتی می شود.
باکتری هایی که بیشتر در ارتباط با عفونت های مرتبط با مراقبت های بهداشتی هستند
- استافیلوکوکوس اورئوس
- استافیلوکوکوس اپیدرمیدیس
- انتروکوکوس فکالیس
- اشریشیا کلی
- کلبسیلا پنومونیه
- پروتئوس میرابیلیس
- سودوموناس آئروژینوزا
- آسینتوباکتر
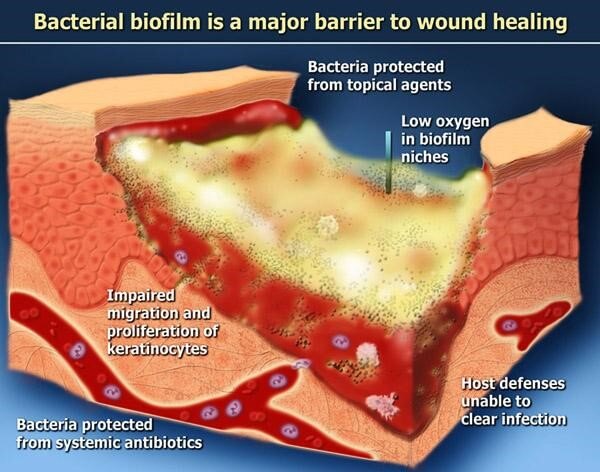
بیوفیلم باکتریایی یک عامل تأثیرگذار تأثیرگذار در بهبود زخم مزمن است. مکانیسم ها به اندازه گونه های باکتریایی موجود در بیوفیلم متنوع هستند. در یک محیط تغییر یافته ، بیوفیلم کلونی چند میکروبی را در خود جای داده است که در آن میکروارگانیسم ها برای حفظ تأثیر نامطلوب محیطی تحت تغییرات فنوتیپی و ژنتیکی قرار می گیرند.
باکتری های بیوفیلم از طریق روشهای مختلف مانع از تکثیر سلول می شوند ، از مهاجرت سلول جلوگیری کرده و باعث از بین رفتن سلول می شوند. اعتقاد بر این است که باکتری های مختلف از طریق تهیه عوامل مختلف فعال زیستی منجر به تداوم التهاب در بستر زخم که عمدتا به علت وجود باکتری هاست می شود.. توانایی باکتری ها برای زنده ماندن در فشار اکسیژن کم به آنها امکان می دهد تا در شرایط نسبتاً کم اکسیژن در بستر زخم دوام بیاورند.
بیوفیلم ها کلونی پیچیده ای از جمعیت باکتریایی هستند که در یک ماده پلیمری محافظ خارج سلولی (EPS) قرار گرفته اند و به آنها کمک می کند تا به یک سطح مناسب بچسبند باکتری های Pseudomonas aeruginosaand Staphylococcus aureus ، دو سویه بسیار رایج عامل بیوفیلم زخم ، هستند گرچه ممکن است بیوفیلم ناشی از برخی سویه های دیگر باشد.
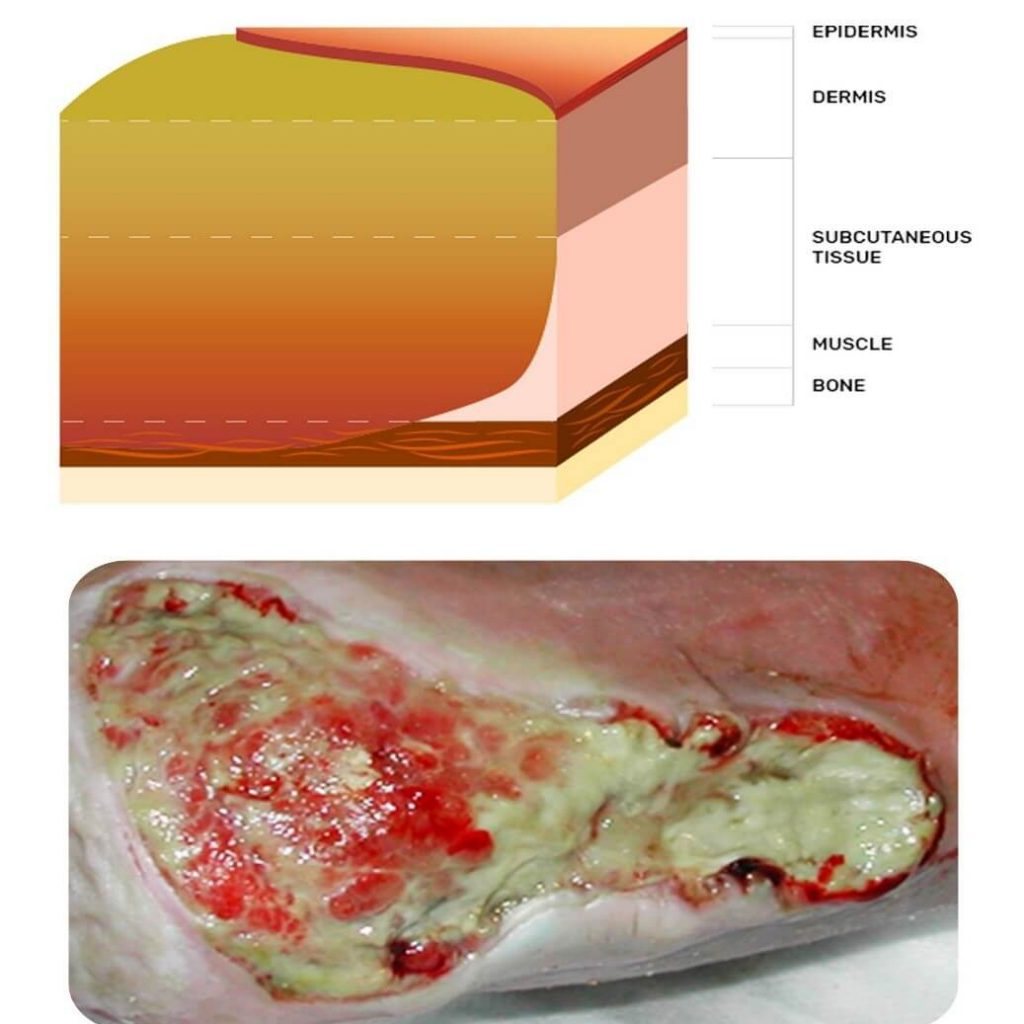
باکتری های بیوفیلم می تواند به طور مستقیم از اپیتلیالیزاسیون جلوگیری کند.
یک بیوفیلم پیچیده کاملاً تشکیل شده روی سیستم ایمنی بدن تاثیر می گذارد. اگرچه بیوفیلم ها به طور مستقیم یا غیرمستقیم در تمام مراحل ترمیم زخم تأثیر می گذارند ، اما بیشترین اثر بیوفیلم روی فاز التهابی در زخم است و سبب افزایش این مرحله می شود.
مهاجرت کراتینوسیت ها نیز در حضور بیوفیلم ها مهار می شود. به طور معمول ، در یک زخم حاد ، تجمع مجدد مایعات در طی چند ساعت پس از آسیب شروع می شود . در یک زخم مزمن ، با وجود تکثیر فعال در حاشیه زخم ، کراتینوسیت ها قادر به مهاجرت نیستند. اگرچه تعدادی از دلایل مانند هیپوکسی ، افزایش فعالیت پروتئاز ، پیری فیبروبلاست در کاهش فعالیت کراتینوسیت ها نقش دارند ، اما علل دقیق مربوط به بیوفیلم هنوز حدس و گمان است.
Kirker و همکارانش با استفاده از روش خراش بررسی اثر بیوفیلم استافیلوکوک بر مهاجرت کراتینوسیت انسان در آزمایشگاه و کاهش قابل توجه مهاجرت و زنده ماندن کراتینوسیت ها و همچنین تغییرات مورفولوژیکی در شکل سلول ، تجزیه اسکلت اکتین و تقسیم هسته ای را مشاهده کردند که همه به علت اثرات سمی باکتریهای بیوفیلم در بستر زخم بوده است .
بیوفیلم و ترمیم زخم
در مجموعه ای از مطالعات موردی ، هارلو (2009 و 2012) مدیریت بیوفیلم زخم را با استفاده از روش هایی چون : دبریدمان ، آنتی بیوتیک ها و عوامل ضد میکروبی و انواع پانسمان ها با دقت توضیح داده شده است. تشکیل بیوفیلم به نظر می رسد مانع تشکیل بافت گرانوله زخم می شود. مدیریت دقیق عفونت ، اگزودا و پاتوفیزیولوژی های زمینه ای عومل مهمی در بهبودی و ترمیم زخم ها هستند.
تحقیقات هارلو همچنین تفاوت های اساسی بین ریشه ، ترکیب و رفتار اسلاف و بیوفیلم را توضیح داد:
Slough (اسلاف )
بافت مرده پروتئینی بدن خود میزبان است ، اما با بافت زنده زیرین در ارتباط است و ساختار سلولی آن از بین رفته است اما چون دیواره سلولی سالم است بافت اسلاف حاوی آب و مایعات است.
بیوفیلم ( biofilm )
یک بافت زنده و مشتق شده از کلونی باکتری ها است که از باکتریها در یک ماتریس EPS تشکیل شده است و تصور می شود اساساً ترکیبی از پلی ساکارید باشد.
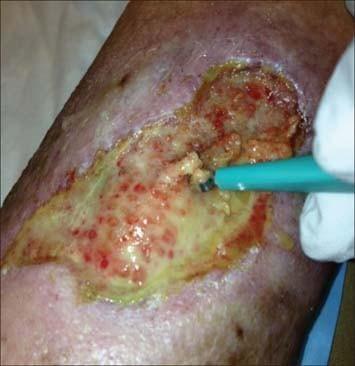
این تمایز در شکل زیر به عنوان مثال نشان داده شده است که علاوه بر لجن محیطی ، یک زخم جراحی جداشده با بیوفیلم پیشنهادی را نشان می دهد. این ادعا که بیوفیلم گاهی اوقات در زخم ها با چشم غیر مسلح قابل مشاهده است بحث زنده ای را در میان جامعه جهانی مراقبت از زخم آغاز کرده است. یک لایه براق ، نیمه شفاف و لغزنده در بستر زخم قبلاً به عنوان علامت بالینی بیوفیلم مورد استفاده قرار گرفته بود ، خصوصاً اگر پس از پاره شدن شدید به سرعت برگردد. اخیراً گفته شده است که هیچ نتیجه قطعی در مورد vivoproof وجود ندارد که بیوفیلم در زخم ها وجود داشته باشد. با این حال ، نویسندگان نیاز به فناوری تشخیص بیوفیلم و پشتیبانی از مراقبت از زخم مبتنی بر بیوفیلم را برجسته می کنند.
برای مبارزه با رشد و اصلاح بیوفیلم ها ، متخصصان مراقبت های بهداشتی باید بهترین روش های مدیریت بیوفیلم را درک کنند. در حال حاضر تصور می شود که از بین بردن و پاکسازی موثرترین وسیله برای از بین بردن و جلوگیری از بیوفیلم ها است. با این حال ، بسیار مهم است که متخصصان مراقبت های بهداشتی بیوفیلم ها را زود تشخیص دهند و به طور مثر منطقه را تمیز کنند.
زخم ها را از نظر بیوفیلم ها باید بررسی کرد
تشخیص زود هنگام برای درمان بیوفیلم ، بسیار حایز اهمیت است. اگرچه مشاهده اولین مراحل تشکیل بیوفیلم دشوار است ، اما ممکن است نشانه هایی از تشکیل بیوفیلم وجود داشته باشد. به طور کلی هیچ علامت واضحی از عفونت با بیوفیلم وجود ندارد. با این حال ، اگر پیشرفت زخم برای چندین هفته متوقف شود ، این ممکن است نشانه ای از تشکیل یک کلنی باشد و مانع روند بهبود طبیعی زخم شود . همچنین مهم است که به دنبال یک لایه شفاف و براق و نسبتا واضح تری از یک کلونی کاملاً تثبیت شده باشید
به طور مرتب ناحیه زخم را تمیز و دبرید کنید – از مهمترین اجزای مدیریت بیوفیلم زخم ، پاکسازی مکرر و از بین بردن بافت های مرده در بستر زخم است. اینها شناخته شده ترین وسیله برای از بین بردن بیوفیلم و جلوگیری از تشکیل بیوفیلم پیشرفته تر است. بهترین روش های دبریدمان برای بیوفیلم ها هنوز از نظر بالینی آزمایش نشده است ، بنابراین متخصص مراقبت های بهداشتی باید هر کدام را برای شرایط بیمار و تجربه پزشک مناسب باشد انتخاب کند.
افزایش دفعات دبریدمان برای پیشگیری از بیوفیلم پیشرفته تر تا زمانی که دبریدمان گسترده ای انجام نشود ، پاک سازی و دبریدمان نمی تواند بیوفیلم را به طور کامل حذف کند. با این حال ، این روشهای مدیریتی می تواند از ایجاد مجدد آن جلوگیری کند. بدون مراقبت مداوم ، بیوفیلم ها می توانند در کمتر از 24 ساعت دوباره ایجاد شوند.
این امر بسیار مهم می کند که متخصصان مراقبت های بهداشتی در صورت مشکوک شدن به بیوفیلم ، دفعات پاکسازی و از بین بردن بافت های مرده و بیوفیلم را افزایش دهند. یک سد محافظتی و داروهای ضد میکروبی موضعی نیز می توانند به کاهش خطر آلودگی مجدد ناحیه زخم کمک کنند.
تحقیقات در مورد اثرات و درمان بیوفیلم ها بسیار فعال است و متخصصان مراقبت های بهداشتی باید جدیدترین متد را کنترل کنند تا اطمینان حاصل کنند که بهترین مراقبت های ممکن را به بیماران ارائه می دهند. از آنجا که بیوفیلم ها می توانند خیلی سریع تشکیل شده و تأثیر بسزایی در کاهش بهبودی زخم داشته باشند ، بسیار مهم است که به موقع و به طور مداوم مورد توجه قرار گیرند. با پیروی از بهترین شیوه های فعلی ، متخصصان مراقبت های بهداشتی می توانند به کاهش خطر تاخیر در ترمیم زخم کمک کرده و نتایج بیماران را بهبود بخشند.
References
1. Phillips PL, Wolcott RD, Fletcher J, Schultz GS. Biofilms made easy. Wounds Int. 2010;1(3).
2. Carver C. How to identify biofilm in a wound. WoundSource. Published August 18, 2015. Accessed December 20, 2017.
3. Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis. 2002;8(9):881-90.
The views and opinions expressed in this blog are solely those of the author, and do not represent the views of WoundSource, Kestrel Health Information, Inc., its affiliates, or subsidiary companies.